中华医学会消化内镜学分会中国抗癌协会肿瘤内镜专业委员会
一、引言
胃癌系起源于胃黏膜上皮的恶性肿瘤,是危害我国人民健康的重大疾病之一。我国幅员辽阔、人口众多,成人幽门螺杆菌(Helicobacter pylori,H Pylori)感染率高达40%一60%[1],属于胃癌高发国家,每年胃癌新发病例约40万例,死亡约35万例,新发和死亡均占全世界胃癌病例的40%[2],降低我国胃癌的发病率和死亡率是亟待解决的重大公共卫生问题。
胃癌的预后与诊治时机密切相关,进展期胃癌即使接受了以外科手术为主的综合治疗,5年生存率仍低于30%[3],且生活质量低,给家庭及国家带来沉重的负担;而大部分早期胃癌在内镜下即可获得根治性治疗,5年生存率超过90%[4],大大节约了医疗资源,但是目前我国早期胃癌的诊治率低于10%,远远低于日本(70%)和韩国(50%)。《中国癌症预防与控制规划纲要(2004-2010)》明确指出,癌症的早期发现、早期诊断及早期治疗是降低死亡率及提高生存率的主要策略。因此,在胃癌高危人群中进行筛查和内镜早诊早治,是改变我国胃癌诊治严峻形势的高效可行途径。
目前,国际上胃癌相关共识主要有美国国家综合癌症网络(NCCN)指南¨1,欧洲肿瘤内科学会(ESOM)、肿瘤外科学会(ESSO)、肿瘤放射学会(ESTRO)联合诊治随访指南忙。和日本胃癌学会指南[6],2011年我国卫生部颁布《胃癌诊疗规范(2011版)》[7],随后印发了指导市、县级医院和农村居民重大疾病医疗保障的《胃癌规范化诊疗指南(试行)》[8],但国内尚缺乏涵盖胃癌筛查与内镜早期诊治等内容的共识意见。为此,由中华医学会消化内镜学分会联合中国抗癌协会肿瘤内镜专业委员会,组织我国消化、内镜、病理、外科、肿瘤等多学科专家共同制定该共识意见。
二、定义及术语
1.本共识所称的胃癌包括食管胃交界部癌(贲门癌)。
2.早期胃癌:(1)早期胃癌(early gastric cancer):癌组织仅局限于胃黏膜层或黏膜下层,不论有无淋巴结转移。(2)早期胃癌的特殊类型:微小胃癌(micro gastric cancer):病灶直径≤5 mm的早期胃癌;小胃癌(small gastric cancer):病灶直径>5~10 mm的早期胃癌。
3.胃癌前状态(precancerous condition):
包括癌前疾病(precancerous diseases)和癌前病变(precancerous lesions)两个概念。前者指与胃癌相关的胃良性疾病,有发生胃癌的危险性,为临床概念,如慢性萎缩性胃炎、胃溃疡、胃息肉、手术后胃、Menetrier病(肥厚性胃炎)、恶性贫血等;后者指已证实与胃癌发生密切相关的病理变化,即异型增生(上皮内瘤变),为病理学概念。
4.上皮内瘤变(intraepithelial neoplasia):
国际抗癌联盟(IARC)于2000年版《消化系统肿瘤病理学和遗传学》[9]中,把上皮内瘤变的概念引入胃肠道癌前病变和早期癌。上皮内瘤变是一种形态学上以细胞学和结构学异常、遗传学上以基因克隆性改变、生物学行为上以易进展为具有侵袭和转移能力的浸润性癌为特征的癌前病变。上皮内瘤变分为二级,即低级别(10w-grade intraepithelial neoplasia,LGIN)和高级别(high—grade intraepithelial neoplasia,HGIN)。LGIN相当于轻度和中度异型增生,HGIN相当于重度异型增生和原位癌。
5.整块切除(en bloc resection):
病灶在内镜下被整块切除并获得单块标本。
6.水平/垂直切缘阳性:
内镜下切除的标本固定后每隔2mm垂直切片,若标本侧切缘有肿瘤细胞浸润为水平切缘阳性,若基底切缘有肿瘤细胞浸润则称为垂直切缘阳性。
7.完全切除(complete resection/R0 resection):
整块切除标本水平和垂直切缘均为阴性称为完全切除。
8.治愈性切除(curative resection):达到完全切除且无淋巴结转移风险。
9.局部复发(10cal recurrence):指术后6个月以上原切除部位及周围1 cm内发现肿瘤病灶。
10.残留(residual):指术后6个月内原切除部位及周围1 cm内病理发现肿瘤病灶[10]。
11.同时性复发(synchronous recurrence):指胃癌内镜治疗后12个月内发现新的病灶:即内镜治疗时已存在但被遗漏的、术后12个月内经内镜发现的继发性病灶[11]。
12.异时性复发(metachronous recurrence):指治疗后超过12个月发现新的病灶。1“。大部分病灶出现在胃内原发病灶的邻近部位,且病理组织类型相同。
三、流行病学
据2008年世界癌症报告统计,胃癌发病率居全球恶性肿瘤第4位,在恶性肿瘤死亡病因中高居第2位[2]。东亚、南美、东欧为胃癌高发区,而北美、澳大利亚、新西兰为低发区。近30年世界各国特别是欧美国家胃癌发病率和死亡率总体呈下降趋势,近端胃癌相对升高。而由于世界人口的不断增长和老龄化,胃癌绝对死亡人数已从1985年的64万上升为2008年的98.9万。按伤残调整寿命年,世界胃癌负担仍居恶性肿瘤前列[13]。
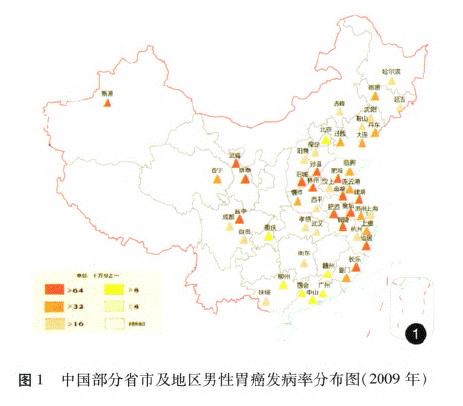
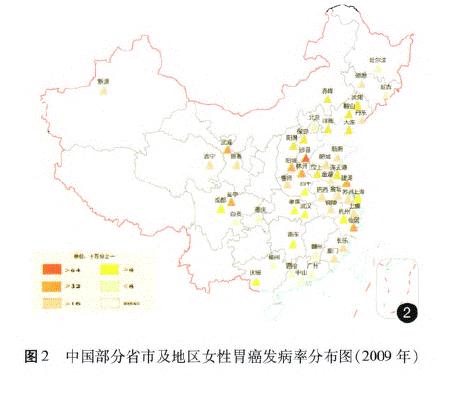
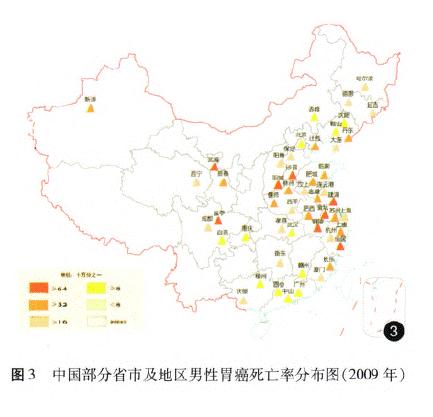
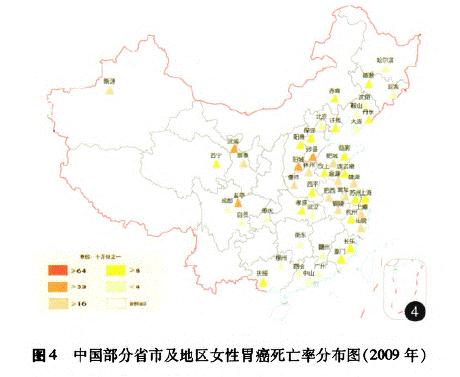
据《中国肿瘤登记年报》报道,胃癌是我国2009年肿瘤登记地区最常见的消化道肿瘤之一,发病率为36.21/10万,同期胃癌的死亡率为25.88/10万,占恶性肿瘤死亡率的第3位[14](图l一4)。我国胃癌地区分布广泛,以西北地区和东南沿海较为集中,多地散在典型高发区,地区差异明显;男性发病率和死亡率约为女性的2倍,农村比城市高出60%一70%,以40~60岁多见,死亡率水平随年龄增长而增加。近20余年来我国的胃癌发病率呈下降趋势,以远端胃癌下降为主,而近端贲门胃底部癌并未下降,在部分食管癌高发区有上升趋势的报道。20世纪70年代至20世纪90年代我国胃癌死亡一直稳居恶性肿瘤死因的第1位,因本世纪肺癌和肝癌发病率及死亡率的快速上升,胃癌退居第3位[15],但我国胃癌绝对死亡数仍占世界同期胃癌死亡数的40%[2]以上。
在日本和韩国,因有国家癌症筛查项目,检出的早期胃癌占全部胃癌的比例可达50%。而中国和西方国家的早期胃癌检出病例只占胃癌的5%~20%。2007年中国上海不同等级的lO个医疗机构的早期胃癌门诊筛选结果显示,胃癌的检出率为2.01%,其中早期胃癌占检出病例的9.61%[16]。因我国并未大规模开展胃癌普查和筛查项目,目前多进行门诊有症状患者的胃镜筛查,总体上同日韩相比差距明显。
四、危险因素
胃癌的发生是多因素参与、多步骤演变的复杂病理过程,是人口学因素、生活饮食因素、遗传基因、感染因素和环境因素等相互作用的综合结果。对胃癌病因学和危险因素的研究不仅有利于胃癌的一级预防,更为正确区分胃癌高危人群,有针对性地进行二级预防提供了重要依据。
(一)胃癌的危险因素
1.人口学因素:年龄和性别等人口学因素是胃癌的危险因素。随着年龄增长,胃癌发病率和死亡率也随之增加,我国在40岁后发病率明显上升,达到峰值后逐渐缓慢下降,30岁以下发病病例较为少见;30岁前胃癌死亡病例很少见,40岁以后胃癌死亡明显增加,并随年龄增长死亡率亦上升。世界各国胃癌发病率和死亡率均为男性高于女性,2008年IARC数据显示胃癌的男女比例为1.8:1,男女发病比例在不同国家范围为(1.1—2.3):l,胃癌发病率高的地区男女比值也相对较高[2]。我国按累积发病率和死亡率计算男性约为女性的2倍。男高女低的趋势并不取决于吸烟差异[17],遗传因素及其他外源因素(如性激素分泌差异[18],饮食习惯及行为差异等)的影响可能导致了胃癌分布的性别差异。
2.生活饮食因素:
(1)高盐饮食:高盐饮食与胃癌的发病率和死亡率升高有关[19],日本一项大型前瞻性随访研究发现每日摄盐超过10g明显增加胃癌发病率,且伴H Pylori感染的萎缩性胃炎患者与胃癌联系更明显[20]。高盐饮食不仅可直接损伤胃黏膜,增加机体对致癌物的易感性,而且高盐食物中含大量硝酸盐,在胃内被还原并与食物中的胺结合后形成亚硝酸胺等N一亚硝基化合物。一项在24个国家39组人群进行的生态学研究发现,男女胃癌死亡率与钠和硝酸盐均显著相关,且与钠的关系较硝酸盐更强[21]。
(2)腌熏煎烤炸食品:此类食品会产生多环芳烃、N一亚硝基化合物等致癌物,在冰岛、日本、乌拉圭及我国少数民族地区的多项研究中显示出其与胃癌关系密切。
(3)不良饮食习惯:不良饮食习惯会导致胃黏膜反复损伤修复,降低胃黏膜的保护作用,长期作用可引发癌变。一项Meta分析提示中国人不吃早餐、饮食不规律、吃饭速度快、暴饮暴食、吃剩饭菜是胃癌的危险因素[22]。
(4)吸烟:多项前瞻性研究发现,吸烟与胃癌发生风险呈剂量反应关系,胃癌风险随每日吸烟量及时长的增加而增加[23-24],且与胃癌的复发和死亡升高相关[25]。
(5)饮酒:酒精可损伤胃黏膜,但对胃癌的影响尚无定论,且与酒的类别、饮用量及时长相关。
3.感染因素:上世纪90年代,国际癌症研究机构IARC、WHO均将H Pylori划归I类致癌因子。Meta分析表明,H Pylori感染可使胃癌发生风险增加2倍[26]。一项前瞻性研究发现2.9%的HPylori阳性患者最终进展为胃癌,而HPylori阴性患者无一例发展为胃癌[27]。12项巢式病例对照研究的汇集分析结果显示,H Pylori阳性人群中非贲门部胃癌的发病率是且Pylori阴性人群的2.97倍[28]。世界人口虽有20亿人感染的H Pylori,但不到1%的H Pylori感染人口最终发展为胃癌,说明H Pylori感染并非胃癌发生的充分条件,胃癌发生是细菌毒力因子与宿主炎症相关的遗传学背景及环境等一系列因素相互作用的结果。多种H Pylori毒力因子,如毒力基因岛(cagA)、空泡毒素(VacA)、部分粘附素和外膜蛋白(OMP)参与胃癌发生过程。尽管如此,Maastricht IV共识报告认为目前尚无特殊的细菌毒力因子标志可用于临床,H Pylori感染是胃癌最重要的危险因素,根除H Pylori将是减少胃癌发病率最有希望的策略[29]。根除厦Pylori能否降低胃癌死亡率,有效减少萎缩和肠化以及内镜下切除早期胃癌后根除且Pylori能否预防异时癌发生,研究结果尚不一致,有待进一步研究证实。
4.遗传因素:流行病学资料提示部分胃癌有家族聚集倾向,其中遗传性弥漫性胃癌(约占胃癌总数的1%一3%)是由编码E-钙黏蛋白(E—cadherin)的CDHl基因突变引起,种系突变携带者一生中有80%的概率发生遗传性浸润性胃癌[30]。其他家族性疾病中也伴发胃癌发病风险升高,如Lynch综合征[31]、家族性腺瘤性息肉病[32]等。因突变明确的遗传性胃癌比例低,散发性胃癌的遗传因素更受关注。近年全基因组关联研究发现了弥漫型胃癌[33]、贲门癌[34]和胃体癌[35]的部分易感位点,揭示了胃癌的复杂性及其亚型间遗传异质性的存在,但具体机制和临床意义尚待研究。散发性胃癌患者一级亲属的遗传易感性较高,这种遗传易感性虽难以改变,但根除H Pylori可以消除胃癌发病的重要因素,从而提高预防效果[36]。
5.其他因素:地质、饮用水等环境因素可能通过与遗传背景、H.Pylori感染、宿主免疫等交互作用影响胃癌的发生。精神心理社会因素(如精神刺激或抑郁)、免疫因素等可能与胃癌发生有一定关联,是否为确证的危险因素还需进一步研究。人群对胃癌防治知识的认知度也是影响胃癌早诊早治重要因素。
6.保护因素:水果和蔬菜摄人是胃癌的保护因素:一项大规模前瞻性研究发现,相比每日摄入水果蔬菜低摄入组,高摄入组的胃癌发生风险降低44%[37],近期有Meta分析显示摄人膳食纤维[38]与胃癌风险呈负相关,食用葱蒜类蔬菜也可减少胃癌发生[39]。关于绿茶与胃癌相关性的Meta分析尚未得出倾向性结论。部分流行病学研究发现维生素c、类胡箩卜素、维生素E及微量元素硒等与胃癌风险呈负相关,但RCT结论尚不统一。食物冷藏技术如冰箱的使用率上升与胃癌风险下降有一定关联。
(二)胃癌的报警症状
报警症状包括:消化道出血、呕吐、消瘦、上腹部不适、上腹部肿块等。报警症状对胃癌的预测作用目前尚有争议:我国台湾地区一项研究显示,对有消化不良症状患者,如为45岁以下,无消瘦、吞咽困难和消化道出血等报警症状,上消化道癌的阴性似然比很低,肯定了部分报警症状的价值[40]。伊朗一项研究提示,食管癌或胃癌与年龄较大、男性、消瘦、呕吐相关,但单独的报警症状作用有限。使用年龄、报警症状和吸烟状态联合区分高危和低危人群,ROC曲线下面积达到0.85,但仍有癌症漏诊,建议如有条件,对消化不良的高龄人群或近期有明显消瘦尽早行内镜检查[41]。国内大规模单中心对超过10万例高H.Pylori感染背景人群内镜资料分析后得出,除吞咽困难和年龄外,其他症状对上消化道癌的预测作用有限,而对胃癌来说,报警症状的作用都非常有限[42]。在我国,有无报警症状并不能作为是否行内镜检查的决策指标,考虑到在有报警症状的人群中单独使用H.Py-lori“检测和治疗”策略漏检肿瘤风险大,不推荐使用[43],结合我国内镜检查费用相对较低,普及率高,胃癌发病率高的现状,对有消化道症状的患者建议行胃镜检查排除胃癌等上消化道肿瘤。
五、病理学
1.早期胃癌病理学分型:胃癌的病理分型比较常用的为Lauren和WHO分型,其中我国在诊断病理领域大多遵循WHO分型方案[44]。WHO分型中胃癌包括以下常见组织学类型[9]:乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、腺鳞癌、鳞癌、小细胞癌、未分化癌。其中管状腺癌还可进一步分成高分化、中分化、低分化腺癌。此外尚有少见类型或特殊类型胃癌。
2.早期胃癌浸润深度分类:早期胃癌根据其浸润的层次又可细分为黏膜内癌(M-carcinoma,MC)和黏膜下癌(SM—carcinoma,SMC)[45]。MC又可分为M1(上皮内癌和/或黏膜内癌仅浸润固有膜表层)、M2(癌组织浸润固有膜中层)和M3(癌组织浸润固有膜深层或黏膜肌层),SMC又可分为SMl(癌组织浸润黏膜下层上1/3)、SM2(癌组织浸润黏膜下层中1/3)和SM3(癌组织浸润黏膜下层下1/3)㈣1。对于黏膜切除标本,SMl-C是指癌组织浸润黏膜下层的深度小于500um。
六、筛查(screening)
胃癌在一般人群中发病率较低(33/10万)[47],且目前尚无简便、有效的诊断方法进行全体人群普查。内镜检查等诊断方法用于胃癌普查需要消耗大量的人力、物力,且由于其是侵入性检查,很多无症状、低胃癌发病风险的患者难以接受,即使日本、韩国等胃癌发病率较高的发达国家也无法对全体人群进行胃癌普查。因此,只有针对胃癌高危人群进行筛查,才是可能行之有效的方法。
(一)筛查对象
胃癌的发病率随年龄增长而升高,40岁以下人群发病率较低[47]。多数亚洲国家设定40~45岁为胃癌筛查的起始临界年龄,胃癌高发地区如日本、韩国等胃癌筛查提前至40岁[48]。我国40岁以上人群胃癌发生率显著上升,因此建议以40岁为胃癌筛查的起始年龄。约半数患者可无报警症状,45岁以下患者发生报警症状的比例更低[49],因此不应因无报警症状而排除筛查对象。约10%的胃癌表现为家族聚集性,胃癌患者亲属胃癌发病率较无胃癌家族史者高4倍[50-51]。
根据我国国情和胃癌流行病学,以下符合第1条和2~6中任一条者均应列为胃癌高危人群,建议作为筛查对象:(1)年龄40岁以上,男女不限;(2)胃癌高发地区人群;(3)H.Pylon感染者;(4)既往患有慢性萎缩性胃炎、胃溃疡、胃息肉、手术后残胃、肥厚性胃炎、恶性贫血等胃癌前疾病;(5)胃癌患者一级亲属;(6)存在胃癌其它高危因素(高盐、腌制饮食、吸烟、重度饮酒等)。
(二)筛查方法
1.血清胃蛋白酶原(pepsinogen,PG)检测:PG I浓度和(或)PGI/PGⅡ比值下降对于萎缩性胃炎具有提示作用,通常使用PG I浓度≤70斗g/L且PG I/PG 11≤3.0作为诊断萎缩性胃炎的临界值”[52-55],国内高发区胃癌筛查采用PGI浓度≤70ug/L且PG I/PGII≤7.0[56]。根据血清PG检测和H.Pylori抗体检测结果可以有效对患者的胃癌患病风险进行分层,并决定进一步检查策略。根据胃癌风险分级,A级:PG(一)、H.Pylori(一)患者可不行内镜检查;B级:PG(一)、H.Pylori(+)患者至少每3年行1次内镜检查;C级:PG(+)、H.Pylori(+)患者至少每2年行1次内镜检查;D级:PG(+)、H.Pylori(一)患者应每年行1次内镜检查[58]。但需要注意的是当萎缩仅局限于胃窦时,PG I及PG I/PGII比值正常[57]。血清PG水平在短时间内较为稳定,可每5年左右重复进行检测。本部分检测不针对胃食管交界癌(贲门癌)。
2.胃泌素17(gastrin一17,G-17):
血清G-17检测可以反映胃窦部黏膜萎缩情况[59]。血清G-17水平取决于胃内酸度及胃窦部G细胞数量。因此,高胃酸以及胃窦部萎缩患者的空腹血清G.17浓度较低。与血清PG检测相结合,血清G-17浓度检测可以诊断胃窦(G一17水平降低)或仅局限于胃体(G一17水平升高)的萎缩性胃炎[60-62]。因此,建议联合检测血清G-17、PG I、PG I/PG II比值及H.Pylori抗体,以增加评估胃黏膜萎缩范围及程度的准确性。
3.上消化道钡餐:日本自1960年起应用x线钡餐检查进行胃癌筛查[63]。最初检查应用8组小x光片,如有异常再进行更详细的11组x光片检查。如果x线钡餐检查发现可疑病变如胃腔直径减小、狭窄、变形、僵硬、压迹、龛影、充盈缺损、黏膜褶皱变化等则行进一步内镜检查[64]。然而,随着内镜技术的快速发展,内镜检查已基本取代x线钡餐检查,成为最常用的胃癌检查手段[65]。在我国,结合医院实际情况,也可酌情考虑使用上消化道x线钡餐检查进行筛查。
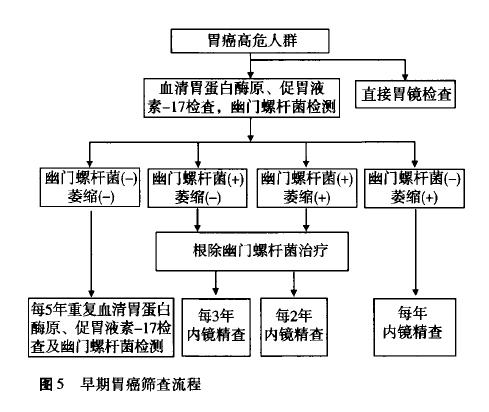
4.内镜筛查:内镜及内镜下活检是目前诊断胃癌的金标准,尤其是对平坦型和非溃疡性胃癌的检出率高于X线钡餐等方法。然而内镜检查依赖设备和内镜医师资源,并且内镜检查费用相对较高、具有一定痛苦,患者接受程度较差,即使对于日本等发达国家而言,也尚未采用内镜进行大规模胃癌筛查[48]。因此,采用非侵入性诊断方法筛选出胃癌高风险人群,继而进行有目的的内镜下精查是较为可行的诊断策略(图5)。
七、内镜精查(intensive endoscopic examination)
(一)检查前准备
1.检查前患者应禁食I>6 h,禁水>2 h,有梗阻或者不全梗阻症状的患者应延长禁食、水时间,必要时应洗胃。
2.检查前应向患者做好解释工作,消除患者的恐惧感,嘱其平静呼吸、不要吞咽口水,避免不必要的恶心反应。
3.检查前10 min给予患者黏液祛除剂(如链霉蛋白酶)及祛泡剂(如西甲硅油)口服,以清除胃内黏液与气泡,可以改善胃部视野,提高微小病变的检出率[66-67]。
4.检查前5 min给予1%盐酸达克罗宁胶浆或l%利多卡因胶浆5~10 rnl含服,或咽部喷雾麻醉。有条件的单位可在麻醉师配合下使用静脉镇静或麻醉[68],可提高受检者内镜检查的接受度。无痛苦胃镜是否可提高早期胃癌检出率目前尚无明确证据,但是无痛苦内镜能够明显的提高受检者内镜检查的接受度。
(二)内镜检查过程[56]。
1.患者取左侧卧位,头部略向前倾,双腿屈曲。
2.经口插镜后,内镜直视下从食管上端开始循腔进镜,依次观察食管、贲门、胃体、胃窦、幽门、十二指肠球部及十二指肠降部。退镜时依次从十二指肠、胃窦、胃角、胃体、胃底贲门、食管退出。依次全面观察、应用旋转镜身、屈曲镜端及倒转镜身等方法观察上消化道全部,尤其是胃壁的大弯、小弯、前壁及后壁,观察黏膜色泽、光滑度、黏液、蠕动及内腔的形状等。如发现病变则需确定病变的具体部位及范围,并详细在记录表上记录。检查过程中,如有黏液和气泡应用清水或去泡剂和去黏液剂及时冲洗,再继续观察。
3.保证内镜留图数量和质量:为保证完全观察整个胃腔,既往有13本学者推荐拍摄40张图片[69]。也有推荐留图22张[70]:直视下,胃窦、胃体下部和胃体中上部,分别按前壁、后壁、大弯、小弯各留1张图;翻转视角下,胃底贲门部留图4张,胃体中上部和胃角各留图3张。如果发现病灶,另需额外留图。同时,需保证每张图片的清晰度。国内专家较为推荐的是40张。
(三)内镜检查技术
1.普通白光内镜:早期胃癌的白光内镜表现并不具有明显的特征性,易与胃炎等良性病变的黏膜改变相混淆。检查时应特别注意与周围黏膜表现不同的局部区域黏膜改变,如:黏膜局部色泽变化(变红或发白),局部黏膜细颗粒状或小结节状粗糙不平,局部黏膜隆起或凹陷,黏膜浅表糜烂或溃疡,黏膜下血管网的消失,黏膜皱襞中断或消失,黏膜组织脆、易自发出血,胃壁局部僵硬或变形等[71-72]。
2.化学染色内镜(chmmoendoscopy):化学染色内镜是在常规内镜检查的基础上,将色素染料喷洒至需观察的黏膜表面,使病灶与正常黏膜对比更加明显,从而有助于病变的辨认及活检的准确性,提高活检的阳性率;并可对早期胃癌的边缘和范围进行较准确的判断,以提高内镜下黏膜切除的完整性。色素内镜使用的染料很多,主要有靛胭脂、亚甲蓝(美蓝)、醋酸和肾上腺素[73-74]。必要时可混合使用,如醋酸+靛胭脂等。
(1)靛胭脂:可显示黏膜细微凹凸病变,正常的胃黏膜表现出清晰的胃小区结构。早期胃癌可以有以下表现:正常胃小区结构消失,黏膜表面呈颗粒样或结节样凹凸异常,颜色发红或褪色,病变区易出血,黏膜僵硬等[75]。
(2)亚甲蓝:亚甲蓝(O.3%一0.5%)不被正常胃黏膜所吸收着色,而肠上皮化生、异型增生及癌性病灶黏膜可吸收亚甲蓝而被染成蓝色,肠上皮化生和异型增生的黏膜着色快而浅,胃癌细胞着色慢(30 min以上),颜色深蓝或黑色,不易冲洗掉[76-77]。
(3)醋酸:1.5%的醋酸喷洒于胃黏膜表面可使黏膜发白,根据黏膜病变及肿瘤分化程度不同,黏膜发白的持续时间变化较大。正常黏膜发白时间较长,而低分化癌或黏膜下层癌发白时间较短[78]。
(4)。肾上腺素:在喷洒0.05 g/L肾上腺素后,非癌黏膜从粉红色变为白色,用放大内镜观察无异常微血管;而癌组织黏膜仍为粉红色,微血管结构扭曲变形[79]。
3.电子染色内镜(digital chromoendoscopy):电子染色内镜在内镜下可以不喷洒染色剂就能显示黏膜腺管形态的改变,从而避免了染料分布不均匀而对病变的错误判断,与色素内镜相比,电子染色内镜还可清晰观察黏膜浅表微血管形态,并且能在普通白光内镜和电子染色内镜之间反复切换对比观察,操作更为简便。
窄带成像技术(narrow band imaging,NBI)使内镜检查对黏膜表层的血管显示更加清楚,不同病变时黏膜血管有相应的改变,根据血管形态的不同诊断表浅黏膜的病变。但是,由于胃腔空间较大,利用光源强度较弱的NBI筛查早期胃癌病灶较困难,多在普通白光内镜下发现疑似胃黏膜病变时,再用NBI结合放大内镜对病灶进行鉴别;提高早期胃癌的诊断率[80-82]。智能电子分光技术(Fuji intelligent chromoendoscopy,FICE)具有较高强度的光源,可选择3种波长的光谱组合成最多达50种的设置,从而获得不同黏膜病变的最佳图像。FICE可以更方便弛提供清晰的血管图像,有助于早期胃癌的诊断,提高活检检查的准确率[81,83-84]。智能电子染色内镜(I-Scan)除了有传统的对比增强和表面增强模式外,还可分别强调微血管形态和黏膜腺管形态[81,85]。
4.放大内镜(magnifying endoscopy):放大内镜可将胃黏膜放大几十甚至上百倍,可以观察胃黏膜腺体表面小凹结构和黏膜微血管网形态特征的细微变化,尤其是与电子染色内镜相结合,黏膜特征显示更为清楚,具有较高的鉴别诊断价值。电子染色内镜结合放大内镜检查,不仅可鉴别胃黏膜病变的良恶性,还可判断恶性病变的边界和范围[86-87]。
5.激光共聚焦显微内镜(confocal caser endomicroscopy,CLE):激光共聚焦显微镜可在普通内镜检查同时,显示最高可放大1 000倍的显微结构,达到“光学活检”的目的[88]。
CLE是对形态学和组织病理学同时诊断的技术,研究证明其对早期胃癌具有较好的诊断价值。CLE可实时模拟组织学检查,清晰显示目标部位胃小凹、细胞以及亚细胞水平的显微结构,易于检出黏膜内早期癌变[89-90]。
6.荧光内镜(fluorescence endoscopy):荧光内镜是以荧光为基础的内镜成像系统,能发现和鉴别普通内镜难以发现的癌前病变及一些隐匿的恶性病变,但是,该方法对设备要求高,检查费用昂贵,目前在临床常规推广应用仍较少。
早期胃癌的内镜下精查应以普通白光内镜检查为基础,全面清晰地观察整个胃黏膜,熟悉早期胃癌的黏膜特征,发现局部黏膜颜色、表面结构改变等可疑病灶,可根据各医院设备状况和医师经验,灵活运用色素内镜、电子染色内镜、放大内镜、超声内镜、荧光内镜、共聚焦内镜等特殊内镜检查技术以强化早期胃癌的内镜下表现,不但可以提高早期胃癌的检出率,而且还能提供病变深度、范围及组织病理学等信息。
(四)早期胃癌的内镜下分型
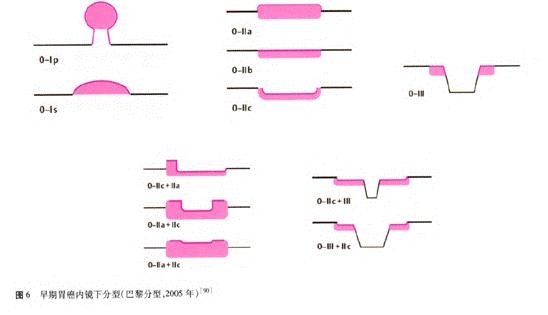
早期胃癌的内镜下分型依照2002年巴黎分型标准及2005年巴黎分型标准更新[45,91]。浅表性胃癌(Type 0)分为隆起型病变(0-I)、平坦型病变(0-II)和凹陷型病变(0-Ⅲ)。0-I型又分为有蒂型(0-Ip)和无蒂型(0-Is)。0-Ⅱ型根据病灶轻微隆起、平坦、轻微凹陷分为0-Ⅱa、0-II b和0-II c三个亚型。0-I型与0-Ⅱa型的界限为隆起高度达到2.5 mm(活检钳闭合厚度),0-Ⅲ型与0-lI C型的界限为凹陷深度达到1.2 mm(活检钳张开单个钳厚度)。同时具有轻微隆起及轻微凹陷的病灶根据隆起/凹陷比例分为0-II C+II a及0-II a+lI C型。凹陷及轻微凹陷结合的病灶则根据凹陷/轻微凹陷比例分为0-Ⅲ+II C和0-II C+Ⅲ型(图6)。
(五)活检病理检查
1.如内镜观察和染色等特殊内镜技术观察后未发现可疑病灶,可不取活检。
2.如发现可疑病灶,应取活检,取活检块数视病灶大小而定。可以按照以下标准进行:病变>1cm,取标本数≥2块;病变>2cm,取标本数≥3块;病变>3cm,取标本数≥4块。标本应足够大,深度应达黏膜肌层。
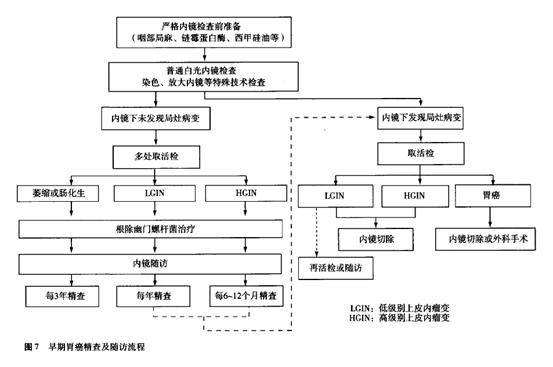
早期胃癌精查及随访流程详见图7。
八、术前评估
(一)病灶浸润深度、范围及淋巴结转移评估术前准确地对肿瘤分期进行评估有助于合理地选择治疗方式。目前,对于无淋巴结侵犯的早期胃癌主张行内镜下微创治疗,而已有淋巴结转移,或者尚未发现淋巴结转移但风险较高的SM2、SM3癌,以及有远处转移的病变仍首选外科手术治疗[92-93],因此术前准确判断肿瘤浸润深度、范围及淋巴结侵犯是选择合理的治疗方式、判断预后和决定治疗成败的关键。关于肿瘤浸润范围的评估主要借助于化学和电子染色内镜来判断,对深度的判断主要依靠超声内镜,但均缺乏统一的标准,准确的评估仍依靠术后标本的病理诊断。EUS在判断肿瘤浸润深度的准确率只有80%~90%,尤其是溃疡型胃癌易误判[94-95]。
1.内镜超声(endoscopic ultrasound,EUS):EUS被认为胃肠道肿瘤局部分期的最精确方法,常用以区分黏膜层和黏膜下层病灶。EUS能发现直径5mm以上淋巴结。淋巴结回声类型、边界及大小作为主要的判断标准,认为转移性淋巴结多为圆形、类圆形低回声结构,其回声常与肿瘤组织相似或更低,边界清晰,内部回声均匀,直径>1 cm;而非特异性炎性肿大淋巴结常呈椭圆形或三角形高回声改变,边界模糊,内部回声均匀[96-97]。关于血管与淋巴结的鉴别,可通过移动镜身从不同角度观察,也可通过彩色多普勒功能加以判别。另外,术前EUS还可用于预测内镜切除的安全性(包括操作时间和出血风险)[98]。
2.CT:CT检查主要用于判断胃癌有无远处转移。CT对进展期胃癌的敏感性约为65%一90%,早期胃癌约为50%:T分期准确率为70%~90%,N分期为40%~70%。因而不推荐使用CT作为胃癌的首选诊断方法,仅用于评估远处转移以及辅助EUS评估局部淋巴结侵犯[99-100]。
3.MRI:增强肝脏MRI检查对了解胃癌的远处转移情况与增强CT的准确度基本一致,但对胃癌N分级的准确度及HGIN:高级别上皮内瘤变诊断淋巴结侵犯的敏感性低于CT检查¨叭],因而不推荐使用MRI对早期胃癌淋巴结侵犯进行评估。
4.PET-CT:PET-CT对胃癌各站转移淋巴结的检出敏感性均较低,特别是对N。站,显著低于CT。并且PET检查费用较高,故不推荐应用PET-CT对早期胃癌淋巴结侵犯进行评估[102-103]。
考虑到成本效益,本共识推荐使用EUS或CT做为早期胃癌术前是否存在淋巴结转移的方法。
(二)病理分型标准及临床处理原则
参照1998年维也纳胃肠上皮肿瘤病理分型标准,根据不同内镜和病理诊断,选择不同的临床处理方式[104-105](表1)。

九、治疗
(一)治疗原则
早期胃癌的治疗方法包括内镜下切除和外科手术。与传统外科手术相比,内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且疗效相当[106-109]。5年生存率均可超过90%。因此,国际多项指南和本共识均推荐内镜下切除为早期胃癌的首选治疗方式。
(二)内镜下切除术
早期胃癌内镜下切除术主要包括内镜下黏膜切除术(endoscopic mucosal resetion,EMR)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)。
1984年日本学者多田正弘等[110]首次报道EMR用于早期胃癌局部病灶全层黏膜组织大块切除以进行病理学检查,判断肿瘤的浸润深度。1994年Takekoshi等[111]发明尖端带有陶瓷绝缘头的新型电刀(IT刀),使更大胃肠道黏膜病灶的一次性完整切除成为可能。1999年日本专家Gotoda等[112]首先报道了使用IT刀进行早期胃癌的完全切除,2003年将其正式命名为ESD。
EMR与ESD适应证最大的区别在于两种方法能够切除的病变的大小和浸润深度不同。EMR对整块切除的病变对有大小限制.、且仅能切除黏膜层病灶;而ESD则无大小限制、可切除SMl层病灶。相比EMR,ESD治疗早期胃癌的整块切除率和完全切除率更高、局部复发率更低,但穿孔等并发症发生率更高[113]。
1.EMR:
(1)定义:EMR指内镜下将黏膜病灶整块或分块切除、用于胃肠道表浅肿瘤诊断和治疗的方法。
(2)分类:EMR大致可归纳为两种基本类型:非吸引法:代表有黏膜下注射.切除法(息肉切除法)、黏膜下注射-抬举一切除法、黏膜下注射一预切一切除法等;吸引法:代表有透明帽法和套扎器法[114]。
最为常用的是透明帽法(EMR with a cap,EMRC)和套扎器法(EMR with ligation,EMRL)。EMRC在内镜前端安置透明塑料帽进行吸引、切除,使EMR操作变得更简单方便,能在狭小的操作空间中切除较大病变、并发症少,但切除的病变大小受透明帽大小的限制。1994年Chaves等[115]首次报道了应用食管曲张静脉套扎装置进行EMR-操作的方法。该方法圈套器很容易将病变套住,切割过程中视野清晰、凝固完全,易于掌握切除深浅度,局部损伤轻微,术中术后出血等并发症少,较为安全,且切除成功率不受病变部位影响。内镜下分片黏膜切除术(endoscopy piecemeal mucosal resection,EPMR)指将病灶分几部分多次切除,适用于>2cm的巨大平坦病变且传统EMR无法一次性完整切除。但其切除的组织标本体外拼接困难,不易评估根治效果,且易导致病变切除不完全或复发[116]。
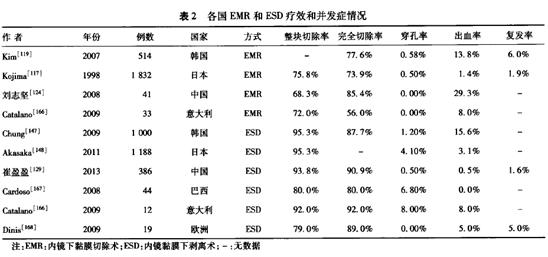
(3)疗效:EMR治疗早期胃癌的整块切除率为56.0%~75.8%,完全切除率为66.1%~77.6%[117-120](表2)。国内缺乏大宗病例报道,大部分研究样本在100例以内,我国EMR治疗早期胃癌的完全切除率为在80%~95%之间,整块切除率为70%左右[121-124]。与胃癌外科根治性手术相比,EMR治疗的患者在术后生存率及病死率方面差异无统计学意义[107],但其术后出血率、病死率、住院时间及住院费用明显更少[108]。
2.ESD:
(1)定义:ESD是在EMR基础上发展起来的新技术,根据不同部位、大小、浸润深度的病变,选择使用的特殊电切刀,如IT刀、Dua刀、Hook刀等,内镜下逐渐分离黏膜层与固有肌层之间的组织,最后将病变黏膜及黏膜下层完整剥离的方法。
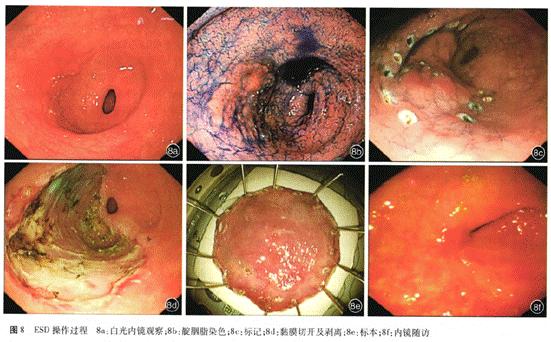
(2)操作步骤:操作大致分为5步:①病灶周围标记;②黏膜下注射,使病灶明显抬起;③环形切开黏膜;④黏膜下剥离,使黏膜与固有肌层完全分离开,一次完整切除病灶;⑤创面处理:包括创面血管处理与边缘检查。见图8。
3.疗效:ESD治疗早期胃癌的整块切除率为86.8%~99.0%,完全切除率为79.9%~97.1%[125-127](表2)。在日本,胃ESD已被公认为一种疗效确切且广泛应用的治疗方式。根据日本卫生部公布的数据,2010年6月份日本共计完成2 111例次胃ESD操作,每年估计有近25000例次[128]。在国内,对于在适应证范围内的早期癌,ESD整块切除率为93.8%~100.0%,完全切除率为84.6%~100.0%[54,129-131]。研究表明,ESD与外科治疗疗效和预后均相当,但复发率相对较高[106-109]。
4.其他内镜治疗方法:内镜下其他治疗方法包括激光疗法、氩气刀和微波治疗等,它们只能去除肿瘤,但不能获得完整病理标本,也不能肯定肿瘤是否完整切除。因此,多用于胃癌前病变的治疗,治疗后需要密切随访,不建议作为早期胃癌的首选治疗方式。
(三)适应证和禁忌证
适应证又分为绝对适应证和相对适应证。绝对适应证有充分的证据支持,而相对适应证仅有初步的证据支持,应在有条件的单位开展进一步的临床试验来证实。内镜下切除治疗主要用于淋巴结转移风险低且可能完整切除的胃癌病变。目前国内尚无统一规范的内镜切除适应证,多以参考日本胃癌指南为主。
日本胃癌治疗指南(2010年版)[6]:EMR或ESD治疗早期胃癌的绝对适应证为:侵犯深度定义为T1a期、病灶大小≤2 cm、且无溃疡性病灶的分化型腺癌。相对适应证(针对cTla期胃癌,只能使用ESD而非EMR治疗):(1)无溃疡性病灶、病灶>2 cm的分化型黏膜内癌;(2)合并溃疡存在、病灶≤3 em的分化型黏膜内癌;(3)无溃疡性病灶、病灶≤2cm的未分化型黏膜内癌。一般情况下,对于EMR/ESD治疗后局部黏膜病灶复发,可完全考虑再行一次ESD治疗。但是,由于目前缺乏重复ESD治疗有效性的证据,因此不推荐将其纳入绝对适应证范围内。
美国NCCN(2013年版)指南[3]:因美国早期胃癌检出率低,目前EMR和ESD在美国尚未广泛用于临床。无论在何部位,小于5mm的病变,ESD和EMR的完全切除率相当,而大于5mm的病变,ESD完全切除率显著优于EMR。当早期胃癌病灶为原位癌,组织学高、中分化(直径小于1.5 cm),局限于黏膜层(Tla)无溃疡表现,无淋巴结转移,未发现淋巴血管浸润时,EMR可作为适当的治疗方法。EMR或ESD治疗低分化、有淋巴血管浸润、有淋巴结转移、或浸润深层黏膜下层的胃癌,应视作不完全切除,应考虑追加胃切除术并淋巴结清扫。
欧洲ESMO-ESSO-ESTRO胃癌诊治和随访指南(2013年版)[5]:早期胃癌(T1a)如为分化良好,≤2cm,局限于黏膜层,无溃疡则适合内镜切除。对于扩展适应证参考日本2010年版胃癌治疗指南。
英国胃癌诊治指南(2011年版)[92]:认为EMR和ESD可根除早期胃黏膜癌(证据等级B级)。内镜治疗是多学科治疗胃癌整体中的一部分。推荐应在有外科转诊能力的大医院开展,内镜医师应受过专业训练,且应多学科协作。
对于上皮内瘤变患者,主要参考维也纳分型标准,若为LGIN可观察随访或内镜下治疗;若为HGIN应内镜或手术治疗[104],目前主要考虑内镜切除治疗。由于内镜下活检取材的局限性,尚不能完全依据活检结果来判定病变的性质[132]。活检病理结果为低级别上皮内瘤变的病变中,10%~18%的病变经内镜下切除后,病理提示为高级别上皮内瘤变或早期胃癌[133]。对可疑病变可结合NBI、FICE、共聚焦等先进内镜技术综合评判病变性质,以决定最佳治疗方案。
国内较为公认的早期胃癌内镜切除适应证:
1.绝对适应证:(1)病灶大小≤2cm、无合并溃疡的分化型黏膜内癌;(2)胃黏膜高级别上皮内瘤变。
2.相对适应证:(1)病灶大小>2cm、无溃疡的分化型黏膜内癌;(2)病灶大小≤3cm、溃疡的分化型黏膜内癌;
(3)病灶大小≤2 cm、无溃疡的未分化型黏膜内癌;(4)病灶大小≤3cm、无溃疡的分化型浅层黏膜下癌;(5)除以上条件外的早期胃癌,伴有一般情况差、外科手术禁忌或拒绝外科手术者可视为ESD相对适应证。
国内目前较为公认的内镜切除禁忌证为:(1)明确淋巴结转移的早期胃癌;(2)癌症侵犯固有肌层;(3)患者存在凝血功能障碍。另外,ESD的相对手术禁忌证还包括抬举征阴性,即指在病灶基底部的黏膜下层注射盐水后局部不能形成隆起,提示病灶基底部的黏膜下层与肌层之间已有粘连;此时行ESD治疗,发生穿孔的危险性较高,但是随着ESD操作技术的熟练,即使抬举征阴性也可以安全地进行ESD。
(四)围手术期处理
1.术前准备:术前对患者常规行超声内镜或CT检查排除壁外肿大淋巴结。评估患者全身状况,排除麻醉及内镜治疗禁忌证。向患者及其家属详细讲述所选内镜切除治疗的操作过程、预期结果、并发症及可能存在复发或转移的风险,需追加外科手术治疗等,签署术前知情同意书。所有患者行心电监护,术前15min给予肌注地西泮和山莨菪碱。特殊情况,可应用丙泊酚静脉麻醉。患者术前必须行凝血功能检查,如异常可能增加内镜术后出血的风险,应予以纠正后再行治疗。对服用抗凝药患者,需根据患者原发病情况,酌情停药5—7 d[134],必要时请相关学科协助处理。
2.术后处理:术后第l天禁食;密切观察血压、脉搏、呼吸等生命体征的变化;进行相关实验室检查和胸部、腹部x线检查,如临床表现及相关检查无异常,术后第2天进流质或软食。术后l周是否复查内镜尚存争议。
(1)术后标本处理:切除的标本需要及时固定并全部完整送检以获得组织病理学诊断。恰当地处理标本是获得正确的病理诊断的基本条件,必要时还可进行免疫组化、分子病理检查等辅助诊断。①固定:术后将整块切除的标本展平、黏膜面朝上用大头针固定于平板上,观察、测量并记录新鲜标本的大小、形状、黏膜病变的肉眼所见(大小、形状、颜色、硬度等),区分近侧断端和远侧断端,拍照后将标本全部浸没于10%中性甲醛溶液中固定;②制片染色:将组织以2mm为间隔连续平行切片,按顺序放入包埋盒,组织脱水、浸蜡、石蜡包埋,切片厚度4—6um;(图9)③病理报告:须描述肿瘤的大体形态、部位、大小、组织学类型、分化程度、浸润深度及切缘、是否有淋巴管和血管浸润[6],以确定内镜下切除是否达到完全切除或还需要补充治疗。

(2)术后用药:
溃疡治疗:内镜下切除早期胃癌后,病变处会形成溃疡,关于是使用质子泵抑制剂(PH)还是H2受体拮抗剂(H2RA)以及使用时限长短目前尚存争议。一项meta分析研究表明[135],在预防胃ESD术后出血方面,使用PPI明显优于H2RA。但是最近日本一项研究发现,在第2次复查内镜后,两者无明显差异[136]。既往研究推荐使用PPI疗程为8周[137]。不过,也有学者推荐服用2周即可[138]。对于EMR术后使用PPI制剂l周[139]。近期研究表明,黏膜保护剂可能有利于溃疡愈合[140]。国内专家大多推荐使用足量、持续PPI治疗,疗程为2—4周,并需加用胃黏膜保护剂。
抗生素使用:对于术前评估切除范围大、操作时间长和可能引起消化道穿孔者,可以考虑预防性使用抗生素。药物的选择参照卫生部抗菌素使用原则,早期胃癌内镜切除术后选用第l或2代头孢菌素,可加用硝基咪唑类药物。术后用药总时间一般不应超过72 h,但可酌情延长。
H.Pylori根除:幽门螺旋杆菌感染被认为是溃疡复发的危险因素,建议ESD术后根除H. Pylori[141]。早期胃癌术后根除H.Pylori,甚至可减少异时性胃癌的发生率[142]。
(五)术后并发症及处理
EMR和ESD治疗早期胃癌及癌前病变,尽管属于微创手术,但受设备器械、操作者经验、技术方法、患者全身情况等因素的影响,仍存在较高的并发症发生率,以ESD更为常
见;主要包括出血、穿孔、狭窄、腹痛、感染等(表2)。
1.出血:内镜治疗并发出血可分为术中急性出血及术后
迟发性出血。急性少量出血是指术中创面渗血或喷射性出血持续1 min以上,内镜能成功止血;急性大量出血是指术中活动性渗血或喷射性出血内镜下止血困难,需中断手术和(或)输血治疗[10]。迟发性出血为内镜治疗术后出血且需要再次内镜下止血的情况,可分为48 h内出血和超过48h出血[143]。迟发性大量出血指术后次日所查血红蛋白较术前下降2 g/dl及以上[144]。
出血发生率:胃ESD术中急性出血率在22.6%~90.6%[145-146];而迟发性出血发生率为3.1%一15.6%[147-152]。位于胃上2/3的病变行ESD出现大出血的风险高于胃下1/3,可能与胃上2/3黏膜下血管更粗大相关[144]。Okada等[153]认为病变大于40 mm是胃ESD迟发性出血的唯一相关危险因素。国内起步较晚,各单位报道的发生率不一,在0.5%~10.8%之间不等[129,154]。长海医院报道154例早期胃癌ESD结果,术中大量出血占3.9%,术后迟发出血率为0.6%[155]。
止血原则:术中出血推荐直接电凝止血,常用电止血钳,也可采用治疗中正在使用的适合直接电凝止血的其他ESD配件,而金属夹止血常会影响下一步操作。对于动脉出血,可以选用电止血钳或热凝止血钳夹闭止血[156]。预防性止血非常重要,如果发现裸露血管,应预防性行电凝止血[118]。对于早期迟发性出血,溃疡面尚松软,可用止血夹或电止血钳止血。而对于晚期迟发性出血,由于溃疡面基底已纤维化,推荐使用黏膜下注射药物止血[156]。术后使用止血药物和足量的质子泵抑制剂。
2.穿孔:术中内镜下发现穿孔、术后腹部平片或CT提示纵隔下有游离气体存在、术中造影见造影剂外溢或临床上可见腹膜刺激征,应考虑为穿孔。
穿孔发生率及危险因素:近端胃壁薄、溃疡、病变组织均是胃内介人性操作引起穿孔的高危因素[149]。Kojima等[117]报道胃EMR患者穿孔发生率为0.5%。而胃ESD穿孔发生率为1.2%~4.1%[147-152],大多数为术中穿孔。病灶大于2 cm、病变位于胃上部被认为是胃ESD术后穿孔发生的危险因素[157]。
穿孔治疗原则:EMR、ESD术中穿孔多数病例可通过金属夹闭裂口进行修补[158]。当穿孔较大时,会有大量气体进入腹腔,形成气腹,可引起生命体征如血压、脉搏、呼吸等发生变化,出现腹腔间隙综合症。一旦腹腔内大量积气,应用空针经皮穿刺抽气,以缓解腹腔内压力。ESD操作中,采用CO:代替空气注气可能减少胃ESD穿孔导致气腹症的发生率[159]。一旦发生穿孔,cO:注气可预防气腹引起的呼吸循环不稳定,并减轻术后呕吐、腹胀等症状,同时还可预防空气栓塞发生[160]。而对于术中忽视的小穿孔,由于术前患者多处于禁食状态,穿孔所致感染相对较轻,经禁食、胃肠减压、抗感染等保守治疗后,小穿孔一般可自行闭合。术后迟发性穿孔可能由于大范围肌肉层剥脱,常难以进行内镜治疗而需要紧急手术。
3.狭窄:胃腔狭窄或变形发生率较低,主要见于贲门、幽门或胃窦部面积较大的ESD术后。ESD术后幽门狭窄发生率为1.9%[161],内镜柱状气囊扩张是一种有效的治疗方式,但存在穿孔风险[162]。黏膜环周缺损>3/4和切除纵向长度>5cm,均是ESD术后发生狭窄危险因素[163]。
4.其他:EMR或ESD治疗后可出现短暂菌血症,但一般无感染相关症状和体征[164],无需特殊处理。ESD在老年人群中应用是普遍认为安全有效的[165-168],但是年龄>75岁的患者需要考虑术后发生气胸的可能性,发生率可达1.6%[148]。
十、术后随访(监测)
1.术后复发率:EMR术后的复发率为1.9%~18.0%,多与切除不彻底相关[117,121,127]。ESD术后的复发率为0.9%~5.1%[169-170],5年生存率为84.6%~97.1%,5年疾病相关生存率达100.0%[125,171]。而国内报道ESD的复发[3]率为2.1%-5.4%[129,154]。
2.复发处理:术后病理提示病变为非治愈性切除时,建议外科手术治疗。但以下情况因为淋巴结转移的风险很低,也可考虑再次内镜下切除或者密切观察随访:(1)水平切缘阳性且病变长度小于6mm的整块切除的分化型腺癌[149],但是满足其它治愈性切除的标准;(2)分块切除的分化型腺癌,但是满足其它治愈性切除的标准[6]。水平切缘阳性率约为2.0%,局部复发率为0.3%。病灶位于胃的上1/3部位和病灶不符合绝对适应证是水平切缘阳性的独立危险因素[172]。
3.随访:关于术后内镜随访,国内较为公认的是治愈性切除后3个月、6个月和12个月各复查1次胃镜,此后每年复查1次胃镜,并行肿瘤指标和相关影像学检查。建议有条件的单位开展研究对患者同时进行肠镜的复查,因早期胃癌的患者中,发生肠道腺瘤的可能性明显高于正常人群[173]。
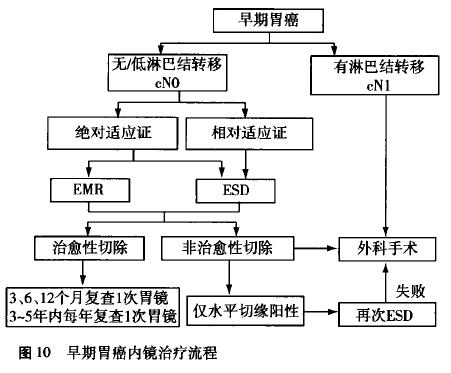
早期胃癌内镜治疗流程详见图10。
参与本共识意见制定的专家(按姓氏拼音排序):
消化、肿瘤及内镜专家:郭强、郭学刚、韩树堂、姜泊、姜慧卿、金震东、李讯、李延青、李兆申、廖专、令狐恩强、刘枫、刘俊、刘志国、吕农华、麻树人、彭贵勇、任旭、施新岗、孙思予、唐秀芬、王邦茂、王贵齐、王凯旋、徐红、许建明、杨爱明、张澍田、智发朝、周平红、邹晓平
病理学专家:高莉、金木兰、吕宁、满晓华、袁嫒
特邀日本专家:河合隆、落合淳志、藤城光弘、田尻久雄
主要执笔者:廖专、孙涛、吴浩、杨帆、邹文斌
参考文献
[1] 张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265_270.
[2]Feday J,Shin H,Bray F,et a1.GLOBOCAN 2008:cancer incidence and mortality worldwide:IARC CancerBase No.10[M].Lyon:IARC press,2010:29.
[3]Ajani JA,Bentrem DJ,Besh S,et a1.Gastric cancer,version2.2013:featured updates to the NCCN Guidelines[J].J Natl Compr Canc Netw,2013,11(5):531-546.
[4]Isobe Y,Nashimoto A,Akazawa K,et a1.Gastric cancer treatmentin Japan:2008 annum report of the JGCA nationwide regis—try[J].Gastric Cancer,2011,14(4):301-316.
[5]Waddell T,Verheij M,Allum W,et a1.Gastric cancer:ESMO—ESSO—ESTR0 Clinical Practice Guidelines for diagnosis.treat—ment and follow-up[J].Ann Oncol,2013,24(Suppl 6):57_63.
[6]Japanese Gastric Cancer Association.Japanese gastric cancertreatment guidelines 2010(ver.3)[J].Gastric Cancer,201 1,14(2):113.123.
[7]中华人民共和国卫生部医政司.胃癌诊疗规范(2011年版)[J].中国医学前沿杂志(电子版),2012,4(5):62-71.
[8]中华人民共和国国家卫生和计划生育委员会.胃癌规范化诊疗指南(试行)[J].中国医学前沿杂志(电子版)2013:(8)56_63.
[9]Hamilton SR,Aaltonen LA,Cancer IAfRo,et a1.Pathology andgenetics of tumours of the digestive system[M].Lyon:IARCpress,2000:8.
[10]施新岗,李兆申,徐丹风,等.内镜黏膜下剥离术治疗早期胃癌[J].中华消化内镜杂志,2008,25(11):574-577.
[11]Yoo JH,Shin SJ,Lee KM,et a1.How Can we predict the pres—enee of missed synchronous lesions after endoscopic submueosaldissection for early gastriccancers or gastric adenomas?[J].JClin Gastroenterol,2013,47(2):e17-22.
[12]Nasu J,Doi T,Endo H,et a1.Characteristics of metaehrenousmultiple early gastric cancers after endoscopic mucosal resection[J].Endoscopy,2005,37(10):990-993.
[13]Soerjomataram I,Lortet—Tieulent J,Parkin DM,et a1.Globalburden of cancer in 2008:a systematic analysis of disability—ad—justed life—years in 12 worldregions[J].Lancet,2012,380(9856):1840—1850.
[14]赫捷,赵平,陈万青.中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:28-297.
[15]邹小农,段纪俊,皇甫小梅,等.2004-2005年全国死因回顾抽样调查胃癌死亡率分析[J].中华预防医学杂志,2010,44(5):390-397.
[16]上海市早期胃癌临床协作组.上海不同等级10个医疗机构早期胃癌的筛选结果比较[J].中华消化内镜杂志,2007,24(1):19-22.
[17]Freedman ND,Derakhshan MH,Abnet CC,et a1.Male predom—inance of upper gastrointestinal adenocarcinoma cannot be ex·plained by differences in tobacco smoking in men veFsus women[J].Eur J Cancer,2010,46(13):2473-2478.
[18]Camargo MC,Goto Y,Zabaleta J,et a1.Sex hormones,hormo—nal interventions,and gastric cancer risk:a meta—analysis[J].Cancer Epidemiol Biomarkers Prey,2012,21(1):20-38.
[19]Ge S,Feng X,Shen L,et a1.Association between Habitual DietarySalt Intake and Risk of Gastric Cancer:A Systematic Re—view of ObservationalStudies[J].Gastroenteml Res Pract,2012,2012:808120.
[20]Shikata K,Kiyohara Y,Kubo M,et a1.A prospective study ofdietary salt intake and gastric cancer incidence in a defined Japa—nese population:the Hisayama study[J].Int J Cancer,2006,119(1):196-201.
[21]Joossens JV,Hill MJ,Elliott P,et a1.Dietary salt,nitrate andstomach cancer mortality in 24 countries.European Cancer Prevention(ECP)and the INTERSALT Cooperative Research Group[J].Inl J Epidemiol,1996,25(3):494-504.
[22]周晓彬,张健,张超英.中国人群生活习惯与胃癌发病关系的Meta分析[J].中国临床康复,2006,10(48):lO—13.
[23]Gonzalez CA,Pem G,Agudo A,et a1.Smoking and the risk ofgastric cancer in the European Prospective Investigation IntoCancer and Nutrition(EPIC)[J].Int J Cancer,2003,107(4):629-634.
[24]Koizumi Y,Tsubono Y,Nakaya N,et a1.Cigarette smoking andthe risk of gastric cancer:a pooled analysis of two prospectivestudies in Japan[j].IntJ Cancer,2004,112(6):1049—1055.
[25]Smrth EC,Capanu M,Janjigian YY,et a1.Tobacco use is ass0-ciated with increased recurrence and death from gastric cancer[J].Ann Surg Oneol,2012,19(7):2088-2094.
[26]Eslick GD,Lim LL,Byles JE,et a1.Association of Helwobacterpylori infection with gastric carcinoma:a meta—analysis[J].Am JGastrocnterol,1999,94(9):2373-2379.
[27]Uemura N,Okamoto S,Yamamoto S,et a1.Helicobacter prioriinfection and the development of gastric cancer[J].N Ensl JMed,2001,345(11):784-789.
[28]Helicobacter and Cancer Collaborative Group.Gastric Cancer andHelwobacter priori:a combined analysis of 12 case control studiesnested within prospective cohoas[J].Gut,2001,49(3):347-353.
[29]Malfertheiner P,Megraud F,O’Morain CA,et a1.Managementof Helicobacter pylori infectionthe Maastricht IV/FIorence Con.sensus Report[J].Gut,2012,61(5):646-664.
[30]Kluijt I,Sijmons RH,Hoogerbrugge N,et a1.Familial gastriccancer:guidelines for diagnosis,treatment and periodic surveil—lance[J].Fam Cancer,2012,ll(3):363-369.
[31]Capolle LG,Van Gfieken NC,Lingsma HF,et a1.Risk and epi—demiologieal time trends of gastric cancer in Lynch syndrome cal'-tiers in theNetherlands[J].Gastroenterology,2010,138(2):487-492.
[32]Offerhaus GJ,Giardiello FM,Krush AJ,et a1.The risk of uppergastrointestinal cancer in familial adenomatous polyposis[J].Gastroenterology,1992,102(6):1980—1982.
[33]Sakamoto H,Yoshimura K,Saeki N,et a1.Genetic variation inPSCA is associated with susceptibility to diffuse··type gastric cane·-er[J].Nat Genet,2008,40(6):730-740.
[34]Abnet CC,Freedman ND,Hu N,et a1.A shared susceptibilitylocus in PLCEI at 10q23 for gastric adenocarcinoma and esophagealsquamous cell carcinoma[J].Nat Genet,2010,42(9):764.767.
[35]Shi Y,Hu Z,Wu C,et a1.A genome-wide association study identifiesnew susceptibility loci for non—eardia gastric cancer at3q13.31 and 5p13.1[J].Nat Genet,201l,43(12):1215.1218.
[36] 中华医学会消化病学分会幽门螺杆菌学组.第四次全国幽门螺杆菌感染处理共识报告[J].中华内科杂志,2012,51(10):832-837.
[37]Larssson SC,Bergkvist L,Wolk A.Fruit and vegetable consump—tion and incidence of gastric cancer:a prospective study[J].Cancer Epidemiol Biomarkers Prey,2006,15(10):1998-2001.
[38]Zhang Z,Xu G,Ma M,et a1.Dietary fiber intake reduces riskfor gastric cancer:a meta-analysis[J].Gastroenterology,2013,145(1):113—120.
[39]Zhou Y,Zhuang W,Hu W,et a1.Consumption oflarge amountsof Allium vegetables redueefl risk for gastric cancer in a meta·-a·-nalysis[J].Gastroenterology,201l,141(1):80-89.
[40]Hsu YC,Yang TH,Liou JM,et a1.Can clinical features stratifyuse of endoscopy for dyspeptic patients with high backgroundprevalence of upper gastrointestinal cancer?[J].Dig Liver Dis,2012,44(3):218-223.
[41]Khademi H,Radmard AR,Malekzadeh F,et a1.Diagnostic ac—curacy of age and alarm symptoms for upper GI malignancy in patientswith dyspepsia in a GIclinic:a 7-year CroSS—sectional study[J].Plos One,2012,7(6):e39173.
[42]Bai Y,Li Z S,Zou D W,et a1.Alarm features and age for pro—dicting upper gastrointestinal malignancy in Chinese patients withdyspepsia with high background prevalence of Helicobacter prioriinfection and upper gastrointestinal malignancy:all endoscopicdatabasereview ofl02,665patientsfroml996t02006[J].Gut,2010,59(6):722-728.
[43]Li XB,Liu WZ,Ge ZZ,et a1.Helicobacter priori“test—and—treat’’strategy is not suitable for the management of patients withuninvestigated dyspepsia in Shanghai[J].Scand J Gastroenterol,2005。40(9):1028—1031.
[44] 国家“863”重大项目“胃癌分子分型与个体化诊疗”课题组.胃癌病理分型和诊断标准的建议[J].中华病理学杂志,2010,39(4):266-269.
[45]The Paris endoscopic classification of superficial neoplastic le—sions:esophagus,stomach,and colon:November 30 to Deeem—bet l,2002[J].Gastrointest Endosc,2003,58(6 Suppl):S3_43.
[46] 杜晓辉,宁宁.早期胃癌内镜治疗与外科治疗的方式选择[J].第三军医大学学报,2013,35(18):1903—1906.
[47] 邹小农,孙喜斌,陈万青,等.2003-2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109—114.
[48]Leung WK,Wu MS,Kakugawa Y,et a1.Screening for gastriccancer in Asia:current evidence and practice[J].1ancet On.col,2008,9(3):279-287.
[49] 李晓波,刘文忠,戈之铮,等.报警症状在胃肠道疾病诊断中的作用[J].胃肠病学,2005,10(4):198-202.
[50]宋永茂,郑树.家族性胃癌的研究进展[J].中国肿瘤临床,2000,27(10):789-791.
[51]覃玉,徐耀初,沈洪兵,等.胃癌的家族聚集性研究[J].中国肿瘤,2001,10(9):503-505.
[52]Miki K,Iehinose M,Kawamura N,et a1.The significance of lowserum pepsinogen levels to detect stomach cancer associated witllextensive chronic gastritis in Japanese subjects[J].Jpn J CancerRes,1989,80(2):111—114.
[53]Miki K,Morita M,Sasajima M,et a1.Usefulness of gastriccancer screening using the serum pepsinogen teat method[J].Am J Gastreenterol,2003,98(4):735-739.
[54]Miki K.Gastric cancer screening using the serum pepsinogen testmethod[J].Gastric Cancer,2006,9(4):245-253.
[55]袁媛.1997-2011年辽宁省庄河地区胃癌高危人群筛查效果评估[J].中华肿瘤杂志,2012,34(7):538-542.
[56]卫生部疾病预防控制局.癌症早诊早治项目技术方案[M].北京:人民卫生出版社,201 l:45-46.
[57]中华医学会消化病学分会,房静远,刘文忠,等.中国慢性胃炎共识意见(2012年,上海)[J].中华消化内镜杂志,2013,30(1):1-6.
[58]Miki K.Gastric cancer screening by combined assay for serumanti-Helieobaeter pylori IgG antibody and serum pepsinogen lev·els一“ABC method”[J].Proc Jpn Acad Ser B Phys Biol Sci,201l,87(7):405-414
[59]Germana B,Di MF,Cavallare LG,et al。Clinical usefulness ofserunl pepainogens I and II.gastrin一17 and anti-Helieobaeterpyloriantibodies in the management of dyspeptic patients in primarycaIe[J].Dig Liver Dis,2005,37(7):501-508.
[60]Sipponen P,Ranta P,Helske T,et a1.Serum levels of amidatedgastrin·17 and pepsinogen I in atrophic gastritis:8n observationalease-control study[J].Scand J Gastroenterol,2002,37(7):785-791.
[61]Vaananen H,Vanhkonen M,Helske T,et a1.Non-endoscopicdiagnosis of atrophic gastritis witII a blood test.Correlation be—tween gastric histology and saturn levels of gastrin--17 and pepsin--ogen I:a muhieentre study[J].Eur JGastroenterol Hepatol,2003,15(8):885-891.
[62]Sipponen P,Graham DY.Importance of atrophic gastritis in di—agnostics and prevention of gastric cancer:application of plasmabiomarkers[J].Scand J Gastroenterol,2007,42(1):2一lO.
[63]Tsubono Y,Hisamiehi S. Scmaning for gastric cancer in Japan[J].Gastric Cancer,2000,3(1):9-18.
[64]Kunisaki C,Ishino J,Nakajima S,et a1.Outcomes of massscreening for gastric carcinoma[J].Ann Surg Oncol,2006,13(2):221-228.
[65]Kozu T,Shoda H,Muramatsu Y,et a1.Screening for GastricCancer in Japan.//New Challenges in Gastrointestinal Endoscopy[M].Springer,2008:163—168.
[66]赵艳春,吴云林,左利平.西甲硅油联合糜蛋白酶溶液作胃镜检查术前准备的临床观察[J].胃肠病学和肝病学杂志,2010,19(11):1019.1021.
[67]王东,方军,厉有名,等.链霉蛋白酶提高胃镜检查图像可见度的前瞻性、多中心、双盲、随机对照临床研究[J].中华消化内镜杂志,2013,30(11):604-607.
[68]徐贵森,吴晓玲,刘合年.无痛内镜术在胃肠道疾病诊治中的应用[J].世界华人消化杂志,2008,16(17):1890-1896.
[69]Hosekawa O,Tsuda S,Kidani E,et a1.Diagnosis of gastriccancer up to three years after negative upper gastrointestinalendoscopy[J].Endoscopy,1998,30(8):669-674.
[70]Yao K.The endoscopic diagaaosis of early gastric cancer[J].AnnGastroenterel,2013,26(1):1 1-22.
[71]今井幸纪,钱冬梅.早期胃癌的内镜诊断要点[J].日本医学介绍,2000,21(10):440—441.
[72]Yada T,Yokoi C,Uemura N.The current state of diagnosis andtreatment for early gastric cancer[J].Diagn Ther Endosc,2013,2013:241320.
[73]韩惠娟,祁金锋.甲苯胺蓝色素胃镜诊断胃癌及其癌前病变的价值[J].医学研究杂志,2009,38(3):98.100.
[74]柏愚,李兆申.早期胃癌的内镜诊断技术临床应用进展[J].中华消化内镜杂志,2008,25(11):614-616.
[75]沙杰,李学良,施瑞华,等.醋酸联合靛胭脂染色诊断早期胃癌及癌前病变的临床价值[J].中华消化内镜杂志,2010,27(12):644-646.
[76]任旭,小越和荣.对比法美蓝染色诊断早期胃癌的价值[J].中华消化内镜杂志,1996,13(3):341-343.
[77]彭贵勇,房殿春,赵京晶,等.卢戈液一美蓝双重染色在早期食管癌诊断中的价值[J].中华消化内镜杂志,2003,20(6):374-376.
[78]赖少清,贺舜,张月明,等.醋酸靛胭脂混合液染色判别早期胃癌及癌前病变组织效果的临床研究[J].中华消化内镜杂志,2011,28(7):388-390.
[79]张树花.内镜下胃粘膜喷洒去甲肾上腺素对提高早期胃癌检出率的临床观察[J].临床医药实践,2002,11(10):751.
[80]Kim KO,Ku YS.Is image-enhanced endoscopy useful for thedia印osis and treatment of gastrointestinal tumor?[J].ClinEndose,2013,46(3):248-250.
[81]钱之欣.消化内镜特殊光学处理成像技术及其应用[J].医学综述,2010,16(18):2829-2832.
[82]徐麟,刘吉勇.窄带成像技术结合放大内镜在早期胃癌诊断中的价值研究[J].中华消化内镜杂志,2009,26(8):415-418.
[83]季锐,李延青.早期胃癌内镜诊断新动向[J].临床内科杂志,2010。27(2):85_87.
[84]余世界,沈磊。罗和生,等.智能染色内镜对早期胃癌的诊断价值探讨[J].中华消化内镜杂志,2011,28(9):502-505.
[85]Kodashima S,Fujishiro M.Novel image-enhanced endoscopywith i-scan technology[J].World J Gastroenterol,2010,16(9):1043—1049.
[86]Uedo N,Fujishim M,Goda K,et a1.Role of naITOW band imaging
for diagnosis of early—stage eaophagogastrie cancer:currentconsensus of experienced endoscopists in Asia—Pacific region[J].Dig Endosc,2011,23(Suppl 1):58-71.
[87]Hayee B,Inoue H,Sato H,et 81.Magnification nalTOW—bandimaging for the diagnosis of early gastric cancer!a itview of theJapanese literature for the Western endoseopist[J].GastrointestEndosc,2013,78(3):452-461.
[88]何振,李延青,于涛,等.共聚焦激光显微内镜对胃癌病理分型的诊断价值[J].中华消化内镜杂志,2010,27(3):1 19.122.
[89] 刘红,李延青,赵幼安,等.用共聚焦内镜对早期胃癌血管形态变化规律的研究[J].中国消化内镜,2007,24(3):3l-34.
[90] 张建娜,于涛,李延青,等.共聚焦显微内镜对胃凹陷型病变的鉴别诊断价值[J].中华内科杂志,2007,46(10):835-837.
[91]Endoscopic Classification Review Group.Update on the parisclassification of superficial neoplastic lesions in the digestive tract[J].Endoscopy,2005,37(6):570378.
[92] AUum WH,Blazeby JM,Griffin SM,et a1.Guidelines for themanagement of oesophageal and gastric cancer[J].Gut,2011,60(11):1449-1472.
[93]胡祥.Et本《胃癌治疗指南》(第3版)解读[J].中国实用外科杂志,2010,(1):25-30.
[94] Mandai K,Yasuda K.Accuracy of endoscopic ultrasonographyfor determining the treatment method for early gastric cancer[J].Gastroenteml Res Pratt,2012,2012:245390.
[95] Yamamoto S,Nishida T,Kato M,et a1.Evaluation of endoscop—ie ultrasound image quality is necessary in endosonographic assessment of early gastric cancer invasion depth[J].GastroenterolRes Pract,2012,2012:194530.
[96]金震东,李兆申.消化超声内镜学[M].北京:科学出版社,2006:269-279.
[97]De Angelis C,Pellieano R,Manfre SF,et a1.Endoscopic ultrasoundin the 2013 preoperative evaluation of gastric cancer[J].Minerva Gastroenteml Dietol,2013,59(1):1—12.
[98]Kikuchi D,IimkaT,Hoteya S,et a1.Prospective Study about theUtility of Endoscopic Ultrasound for Predicting the Safety of EndoscopieSubmucosalDissection in Early Gastric Cancer(T—HOPE0801)[J].Gastroenterol Res Pratt,2013,2013:329385.
[99]刘相文,孙波,国同歌,等.16排螺旋CT在胃癌诊断中的应用[J].中国实验诊断学,2010,14(6):958-959.
[100]孙蕴伟,诸琦,谭继宏,等.低频超声小探头联合螺旋CT检查对胃癌术前分期的评价[J].中华消化内镜杂志,2003,20(3):170—174.
[101] 严超,朱正纲,燕敏,等.磁共振成像和多层螺旋CT对胃癌术前分期的比较研究[J].中国现代医学杂志,2005,15(19):2951-2955.
[102]Dassen AE,Lips DJ,Hoekstra CJ,et a1.FDG—PET has no definiterole in preoperative imaging in gastric cancer[J].Eur JSurg Oncol,2009,35(5):449455.
[103]仲海,严超,燕敏,等.胃癌术前分期的研究现状[J].世界华人消化杂志,2011,19(1):48-56.
[104]Schlemper RJ,RiddeU R H,Kato Y,et a1.The Vienna classi.flcation of gastrointestinal epithelial neoplasia[J].Gut,2000,47(2):251-255.
[105]Dixon MF.Gastrointestinal epithelial neoplasia:Vienna revisi·
ted[J].Gut,2002,51(1):130—131.
[106]Fukase K,Matsuda T,Suzuki M,et a1.Evaluation of the effi—cacy of endoscopic treatment for gastric Cancer considered interms of long·term prognosis.A comparison with surgical treat—ment[J].Dig Endose,1994,6(3):24l·247.
[107]Choi KS,Jung HY,Choi KD,et a1.EMR versus gastrectomyfor intramueosal gastric cancer:comparison of long--term out--comes[J].Gastrointest Endosc,2011,73(5):942-948.
[108]王洪升,刘运祥,黄留业,等.内镜下黏膜切除治疗早期胃癌的临床研究[J].中国医学工程,2013,(1):7-8.
[109]Chin PW,Teoh AY,To KF,et a1.Endoscopic submueosal dissection(ESD)compared with gastrectomy for treatment of earlygastric neoplasia:a retrospective eohoa study[J].Surg En—dosc,2012,26(12):3584-3591.
[110]Tada M,Shimada M,Murakami F.Development of the strip—off
biopsy[J].Gastroenteml Endose,1984,26(6):833-839.
[111]Takekoshi T,Baba Y,(ha H,et a1.Endoscopic resection ofearly gastric carcinoma:results of a retrospective analysis of 308cases[J].Endoscopy,1994,26(4):352-358.
[112]Gotoda T,Kondo H,0no H,et a1.A new endoscopic mucosalresection procedure using∞insulation—tipped electrosurgicalknife for rectal flat lesions:report of two cases[J].GastrointestEndosc,1999,50(4):560-563.
[113]Uall J,Chen S,Zhang Y,et a1.A meta—analysis of endoscopicsubmucosal dissection and EMR for early gastric cancer[J].Gastrointest Endosc,2012,76(4):763-770.
[114]Yamamoto H.Kita H.Endoscopic therapy of early gastric canc—er[J].Best Pract Res Clin Gastroenteml,2005,19(6):909-926.
[115]Chaves DM,Sakai P,Mester M,et a1.A new endoscopic tech—nique for the resection of flat polypoid lesions[J].GastrointestEndosc,1994,40(2 Pt 1):224-226.
[116]Horiki N,Omata F,Uemura M,et a1.Itisk for local recurrenceof early gastric cancer treated witll piecemeal endoscopic mucosalresection during a 10一yearfollow—up period[J].Surg Endosc,2012,26(1):72-78.
[117]Kojima T,Parra—Blanco A,Takahashi H,et a1.Outcome of en—doseopic mucosal resection for early gastric cancer:review of theJapaneseliterature[J].Gastrointest Endusc,1998,48(5):550-555.
[118]Park CH,Lee SK.Preventing and Controlling Bleeding in Gas—tric Endoscopic Submueosal Dissection[J].Clin Endosc,2013,46(5):456-462.
[119]Kim JJ,Lee JH,Jung HY,et 81.EMR for early gastric cancerin Korea:a multieenter retrospective study[J].Gastrointest Endosc,2007,66(4):693-700.
[120]Oda I,Saito D,Tada M,et a1.A multicenter retrospectivestudy of endoscopic resection for early gastric cancer[J].Gas—tric Cancer,2006,9(4):262-270.
[121]连元,令狐恩强,王志强,等.胃上皮内瘤变与早癌内镜下粘膜切除术(EMR)后复发率的调查研究[J].中国继续医学教育,201l,03(12):101.103.
[122]华娴,陈志荣,任伯良.黏膜切除术治疗早期胃癌[J].中国医药导刊,2010,12(11):1905.1906.
[123]刘变英,杨嫦娥,李小会,等.内镜下黏膜切除术在早期胃癌治疗中的应用[J].中国消化内镜,2007,24(3):24-26.
[124]刘志坚,胡伟,朱萱,等.双钳道内镜黏膜切除术治疗早期胃癌及癌前病变41例[J].实用医学杂志,2008,24(7):1209.1210.
[125]Toyonaga T,Man—i M,East JE,et a1.1,635 Endoscopic sub.mucosal dissection c蝴in the esophagus,stomach,and colorectum:complication rates and long-term outcomes[J].SurgEndosc,2013,27(3):1000—1008.
[126]Okada K,Fujisaki J,Yoshida T,et a1.Long-term outcomes ofendoscopic submucosal dissection for undifferentiated-type earlygastric cancer[J].Endoscopy,2012,44(2):122-127.
[127]Park JC,Lee SK,Seo JH,et a1.Predictive factors for local re—currence after endoscopic 1.esection for early gastric c811cer:long·term clinical outcome in a single—center experience[J].Surg Endosc,2010,24(11):2842-2849.
[128]Ministry of Health.Labor and weffare[z],2010.
[129]崔盈盈,卢忠生,令狐恩强,等.内镜黏膜下剥离术对治疗早期胃癌的临床应用价值[J].胃肠病学和肝病学杂志,2013,22(4):341-343.
[130]周炳喜,李晓芳,张慧丽.内镜黏膜下剥离术治疗早期胃癌疗效评价[J].中国实用医药,2013,8(15):57-58.
[131] 聂莉华,王新仁,谭细生.内镜黏膜下剥离术治疗30例早期胃癌[J].南昌大学学报(医学版),2012,52(8):67-69.
[132]张游,令狐恩强,卢忠生,等.术前活检在胃黏膜病变内镜黏膜下剥离术治疗中的价值分析[J].中华消化内镜杂志,2012,29(3):151—154.
[133] Kim YJ,Park JC,Kim JH,et a1.Histologic diagnosis based onforceps biopsy is not adequate for determining endoscopic treat·ment of gastric adenomatous lesions[J].Endoscopy,2010,42(8):620-626.
[134]Veitch AM,Banlin TP,Gershlick AH,et a1.Guidelines for themanagement of anticoagulant and antiplatelet therapy in patientsundergoing endoscopicprocedures[J].Gut,2008,57(9):1322.1329.
[135]Yang z,Wu Q,“u z,et a1.Proton pump inhibitors versushistamine-2--receptor antagonists for the management of iatrogen-·ic gastric ulcer after endoscopic mucosal resection or endoscopicsubmucosal dissection:a meta-analysis of randomized trials.Digesfion,2011,84(4):315-320.
[136] Imaeda H,Hosoe N,Suzuki H,et a1.Effect of lansoprazole ver-SOS roxatidine on prevention of bleeding and promotion of ulcerhealing after endoscopic submucosal dissection for superficial gas—tric neoplasia[J].J Gastroenteml,2011,46(11):1267—1272.
[137]Goto 0,Fujishiro M,Kodashima S,et a1.Shoa—term healingprocess of artificial ulcers after gastric endoscopic submueosaldissection[J].Gut Liver,2011,5(3):293-297.
[138]Niimi K,Fujishiro M,Goto O,et a1.Prospective single—armtrim of two—week rabeprasole treatment for ulcer healing aftergastric endoscopic submucosal dissection[J].Dig Endosc,2012,24(2):110-116.
[139]Lee SY,Kim JJ,Lee JH,et a1.Healing rate of EMR—inducedulcer in relation to the duration of treatment with omeprazole[J].Gastrointest Endosc,2004,60(2):213-217.
[140]Shin WG,Kim SJ,Choi MH,et a1.Can rebamipide and protonpump inhibitor combination therapy promote the healing of endoscopicsubmucosal dissection—induced ulcers?A randomized,prospective,multicenter study[J].Gastrointest Endosc,2012,75(4):739-747.
[141]Huang Y,Kakushima N,Takizawa K,et a1.Risk factors for recurrenceof artificial gastric ulcers after endoscopic submucosaldissection[J].Endoscopy,2011,43(3):236-239.
[142] Fukase K,Kato M,Kikuchi S,et a1.Effect of eradication ofHelicobacter pylori on incidence of metachmnous gastric earcino—ilia after endoscopic resection of early gastric cancer:an open—label,randomisod controHed trial[J].Lancet,2008,372(9636):392-397.
[143]Lim SM,Park JC,Lee H,et a1.Impact of cumulative time onthe clinical outcomes of endoscopic submucosal dissection ingastric neoplasm[J].Surg Endoec,2013,27(4):1397—1403.
[144]Oda I,Gotoda T,Hamanaka H,et a1.Endoscopic submucosaldissection for early gastric Cancer:Technical feasibility,operationtime and complications from a large consecutive series[J].Dig Endosc,2005,17(1):54-58.
[145]Jeon SW,Jung MK,Cho CM,et a1.Predictors of immediatebleeding during endoscopic submucosal dissection in gastric le—sions[J].Surg Endosc,2009,23(9):1974—1979.
[146] Jang JS,Choi SR,Graham DY,et a1.Risk factors for immedi·ate and delayed bleeding associated with endoscopic submucosaldissection of gastric neoplastic lesions[J].Scand J Gastroen—teml,2009,44(11):1370-1376.
[147]Chung IK,Lee JH,Lee SH,et 81.Therapeutic outcomes in1000 cases of endoscopic submucosal dissection for early gastricneoplasms:Korean ESD Study Group multicenter study[J].Gastrointest Endosc,2009,69(7):1228—1235.
[148]Akasaka T,Nishida T,Tsutsui S,et a1.Short-term outcomes ofendoscopic submueosal dissection(ESD)for early gastric neo—plasm:multicenter survey by osaka university ESD study group[J].Dig Endosc,2011,23(1):73-77.
[149]Toyokawa T,Inaba T,Omote S,et a1.Risk factors for perfom—tion and delayed bleeding associated埘tll endoscopic submucosaldissection for early gastric neoplasms:analysis of 1 123 lesions[J].J Gastroenterol Hepatol,2012,27(5):907-912.
[150]Goto 0,Fujishiro M,Oda I,et a1.A muhicenter survey of themanagement after gastric endoscopic submucosal dissection relat—ed to postoperative bleeding[J].Dig Dis Sci,2012,57(2):435-439
[151]Miyahara K,1wakiri R,Shimoda R,et a1.Perforation and post·operative bleeding of endoscopic submucosal dissection in gastrictumors:analysis of 1 190 lesions in low-·and hish-·volume centersin Saga,Japan[J].Digestion,2012,86(3):273-280.
[152]Kim M,Jeon SW,Cho KB,et a1.Predictive risk factors of perforationin gastric endoscopic submucosal dissection for earlygastric cancer:a large,multicenter study[J].Surg Endosc,2013,27(4):1372—1378.
[153]Okada K,Yamamoto Y,Kasuga A,et a1.Risk factors for de—layed bleeding after endoscopic submucesal dissection for gastricneoplasm[J].Surg Endosc,2011,25(1):98—107.
[154]王倍,房津辉,张丽丽,等.内镜黏膜下剥离术治疗早期胃癌的l临床分析[J].中华临床医师杂志(电子版)。201l,(12):3653-3655.
[155]侯晓佳,李兆申,施新岗,等.内镜黏膜下剥离术的疗效及出血危险因素分析[J].中华消化内镜杂志,2012,29(10):549-553.
[156]Oda I,Suzuki H,Nonaka S,et a1.Complications of gastric en—doscopic submucesal dissection[J].Dig Endosc,2013,25(Suppl 1):71-78.
[157]Ohm T,Ishihara R,Uedo N,et a1.Factors predicting perforationduring endoscopic submucosal dissection for gastric cancer[J].Gastrointest Endosc,2012,75(6):1159.1165.
[158]Minami S,Goteda T,Ono H,et a1.Complete endoscopic closureof gastric perforation induced by endoscopic resection ofearly gastric cancer using endoclips Call prevent surgery(withvideo)[J].Gaatrointest Endosc,2006,63(4):596-601.
[159]Nonaka S,Saito Y,Takisawa H,et a1.Safety of carbon dioxideinsufflation for upper gastrointestinal tract endoscopic treatmentof patients under deepsedation[J].Surg Endosc,2010,24(7):1638—1645.
[160]Maeda Y,Hirasawa D,Fujita N,et 81.A prospective,random—ized,double—bhnd,controlled trial on the efficacy of carbon di—oxide insufflation in gastric endoscopic submucosal dissection[J].Endoscopy,2013,45(5):335-341.
[161]Iizuka H,Kakizaki S,Sohara N,et a1.Stricture after endo—scopic submucosal dissection for early gastric cancers and adenomas[J].Dig Endosc,2010,22(4):282-288.
[162]Tsunada S,Ogata S,Mannen K,et a1.Case series of endoscopicballoon dilation to treat a stricture caused by eircumferentialresection of the gastric antrum by endoscopic submucosaldissection[J].Gastrointest Endosc,2008,67(6):979-983.
[163]Coda S,Oda I,Gotoda T,et a1.Risk factors for cardiac andpyloric stenosis after endoscopic submueosal dissection,and elfieacyof endoscopic balloon dilation treatment[J].Endoscopy,2009,41(5):421-426.
[164]Lee TH,Hsueh PR,Yeh WC,et a1.10w frequency of bactere—mia after endoscopic mucosal resection[J].Gastrointest Endose,2000,52(2):223-225.
[165]Abe N,Gotoda T,Hirasawa T,et a1.Multicenter study of thelong—terra outcomes of endoscopic submucasal dissection for earlygastric Cancer in patients 80 years of age or older[J].GastricCancer,2012,15(1):70-75.
[166]Catalano F,Trecca A,Rodella L,et a1.The modemtreatmentof early gastric cancer:our experience in an Italian cohort[J].Surg Endosc,2009,23(7):1581—1586.
[167]Cardoso DM,Campoli PM,Yokoi C,et a1.Initial experience inBrazil with endoscopic submucosal dissection for early gastriccancer using insulation—tipped knife:a safety and feasibilitystudy[J].Gastric Cancer,2008,11(4):226-232.
[168]Dinis·Ribeiro M,Pimentel—Nunes P,Monso M,et a1.A Euro—pearl case series of endoscopic submucosal disscction for gastricsuperficiallesions[J].Gastrointest Endosc,2009,69(2):350-355.
[169]Jang JS,Choi SR,Qureshi W,et a1.10ng—term outcomes ofendoscopic submucesal dissection in gastric neoplastic lesions ata single institution in South Korea[J].Scand J Gastroenterol,2009,44(1 1):1315—1322.
[170]Goto 0,Fujishire M,Kodashima S,et a1.Outcomes of endoscopicsubmucosal dissection for early gastric cancer with specialreference to validation for curability criteria[J].Endoscopy,2009,41(2):118—122.
[171]Isemoto H,Shikuwa S,Yamaguchi N,et a1.Endoscopic sub—mucosal dissection for early gastric cancer:a large·-scale feasi--bility study[J].Gut,2009,58(3):331-336.
[172]Numata N,Oka S,Tanaka S,et a1.Risk factors and manage—ment of positive horizontal margin in early gastric cancer resec—ted by en bloc endoscopicsubmucosal dissection[J].GastricCancer,2014.[Epub ahead of print].
[173]Lee KJ,Kim JH,Kim SI,et a1.Clinical significance of colonoscopicexamination in patients witlI early stage of gastric Beg)-plasm undergoing endoscopicsubmueosal dissection[J].ScandJ Gastroenterel,2011,46(11):1349·1354.
(收稿日期:2014-05-26)